DE LANGE WEG ‘VAN MOLECULE TOT MEDICIJN’
DE LANGE WEG ‘VAN MOLECULE TOT MEDICIJN’
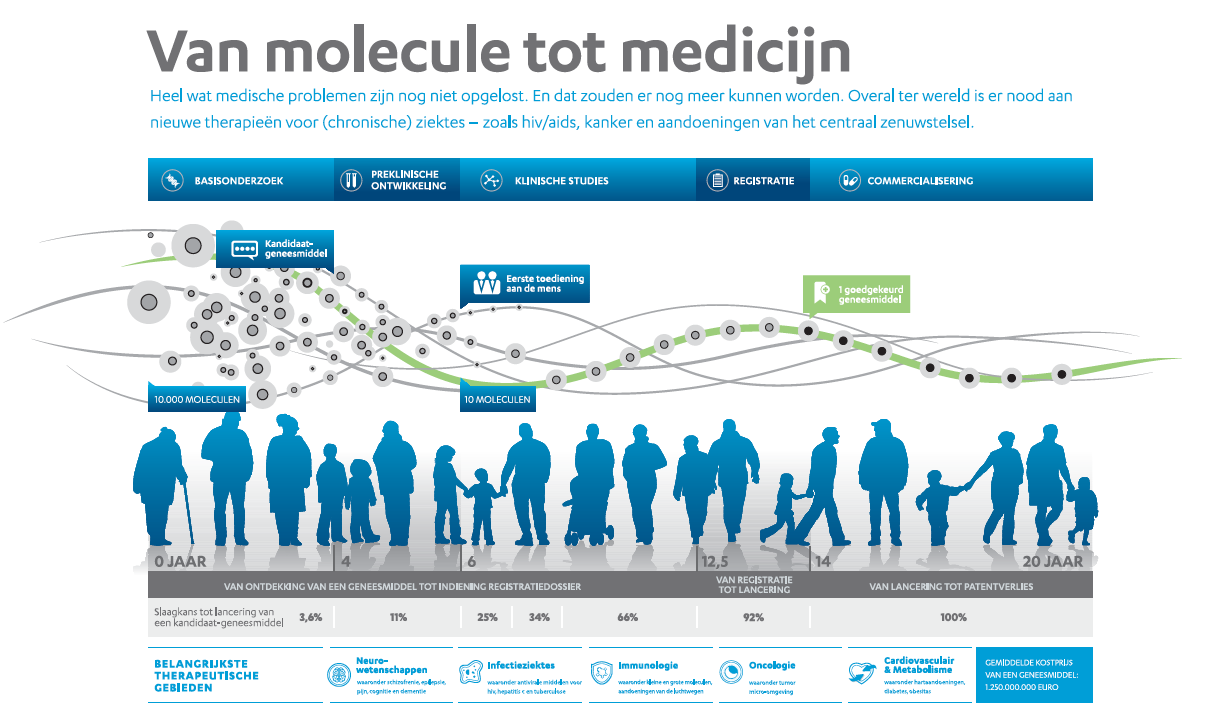
De ontdekking, ontwikkeling en op de markt brengen van een nieuw geneesmiddel neemt jaren in beslag. Gemiddeld duurt het twaalf tot veertien jaar vooraleer een molecule een verkoopbaar medicijn wordt. Het is niet alleen een langdurig, maar ook risicovol en duur traject, zonder garanties op slagen.
Niet alleen het wetenschappelijk onderzoek zelf vergt veel tijd. Ook tientallen andere afdelingen worden in de loop van het ontwikkelings- en registratieproces ingeschakeld.
In het basisonderzoek speuren onderzoekers naar een doelwit (‘target’), meestal een defect eiwit. De opdracht bestaat erin precies die molecule te vinden die op een veilige en efficiënte manier het gezochte effect kan bereiken. In de preklinische ontwikkelingsfase worden de meest veelbelovende moleculen verder uitgetest, zowel op cellulair niveau (in vitro) als in levende proefdieren (in vivo). Alleen de meest veelbelovende molecule(n) maken kans om het tot kandidaat-geneesmiddel te schoppen.
Is het kandidaat-geneesmiddel dat werd geselecteerd, voldoende veilig om op mensen te worden getest? Dan starten de klinische studies bij gezonde vrijwilligers (fase 1), gevolgd door studies bij kleine groepen patiënten (fase 2) en grotere groepen patiënten (fase 3). Daarbij zijn vooral de veiligheid en doeltreffendheid van de actieve stof doorslaggevend, evenals hoe die zich in het lichaam gedraagt (opname, verdeling, uitscheiding). Pas na de indiening van een vaak zeer uitgebreid dossier bij de bevoede autoriteiten en de goedkeuring ervan kan een geregistreerd geneesmiddel op de markt worden gebracht. In dat registratiedossier zitten alle cruciale gegevens uit het voorafgaande basis-, preklinisch en klinisch onderzoek.
Na de registratie begint de chemische en farmaceutische productie op volle toeren te draaien om het geneesmiddel zo snel mogelijk op de markt te kunnen brengen. De medische wereld wordt intussen ingelicht over het nieuwe medicijn en met de overheid wordt over de prijs en terugbetaling onderhandeld. Zodra dat alles rond is, kan het geneesmiddel worden verdeeld via de groothandel en apotheek. Het spreekt vanzelf dat de veiligheid ook nadien nog nauwgezet wordt opgevolgd en dat eventueel bijkomende klinische studies (fase 4) worden uitgevoerd.
Meer over de ontwikkeling van een geneesmiddel vindt u hier:
