Innovationsanreize
Medizinische Innovation muss bei den Menschen ankommen

Wir haben das Glück, in einem der leistungsfähigsten Gesundheitssysteme weltweit zu leben. Patient:innen in Deutschland können sich darauf verlassen, medizinisch hochwertig versorgt zu werden. Laut Untersuchung des europäischen Pharmaverbandes EFPIA ist kein Land in Europa in der Lage, so schnell so viele innovative Arzneimittel in die Versorgung zu bringen wie Deutschland. Forschende Pharmaunternehmen haben daran einen wesentlichen Anteil.
Keine andere Branche in Deutschland investiert proportional gesehen so viel in Forschung und Entwicklung wie die Pharmabranche: Fast jeder fünfte Umsatz-Euro fließt in die Entwicklung neuer Wirkstoffe. Rund 90 % aller klinischen Studien in Deutschland werden von forschenden Pharmaunternehmen initiiert. Für die medizinische Versorgung der Bevölkerung und die Bewältigung gesundheitlicher Herausforderungen wie etwa eine Pandemie sind forschende Unternehmen wie Janssen unverzichtbar.

AMNOG: Anreize für eine schnelle Markteinführung und Verfügbarkeit von innovativen Arzneimitteln
Damit Patient:innen in Deutschland Zugang zu neuen Medikamenten haben, müssen diese nach der Zulassung von den Herstellern in den Markt eingeführt werden. In Deutschland gibt es hierfür seit 2011 ein verbindliches Verfahren, das nach dem zugrundeliegenden Gesetz benannt ist: das Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG). Das AMNOG bringt neue Medikamente nach ihrer Zulassung evidenzbasiert, d. h. nach erwiesener Wirksamkeit, in die Versorgung, noch bevor mit den Krankenkassen ein Erstattungspreis vereinbart wurde. Mit anderen Worten: Das Verfahren sorgt dafür, dass Patient:innen unmittelbar nach der Zulassung Zugang zu innovativen Medikamenten und Therapien haben. Dabei folgte das AMNOG bisher – vereinfacht gesprochen – dem Prinzip „gleiche Preise für gleich gute Medikamente“ und „etwas höhere Preise für etwas bessere Medikamente“.
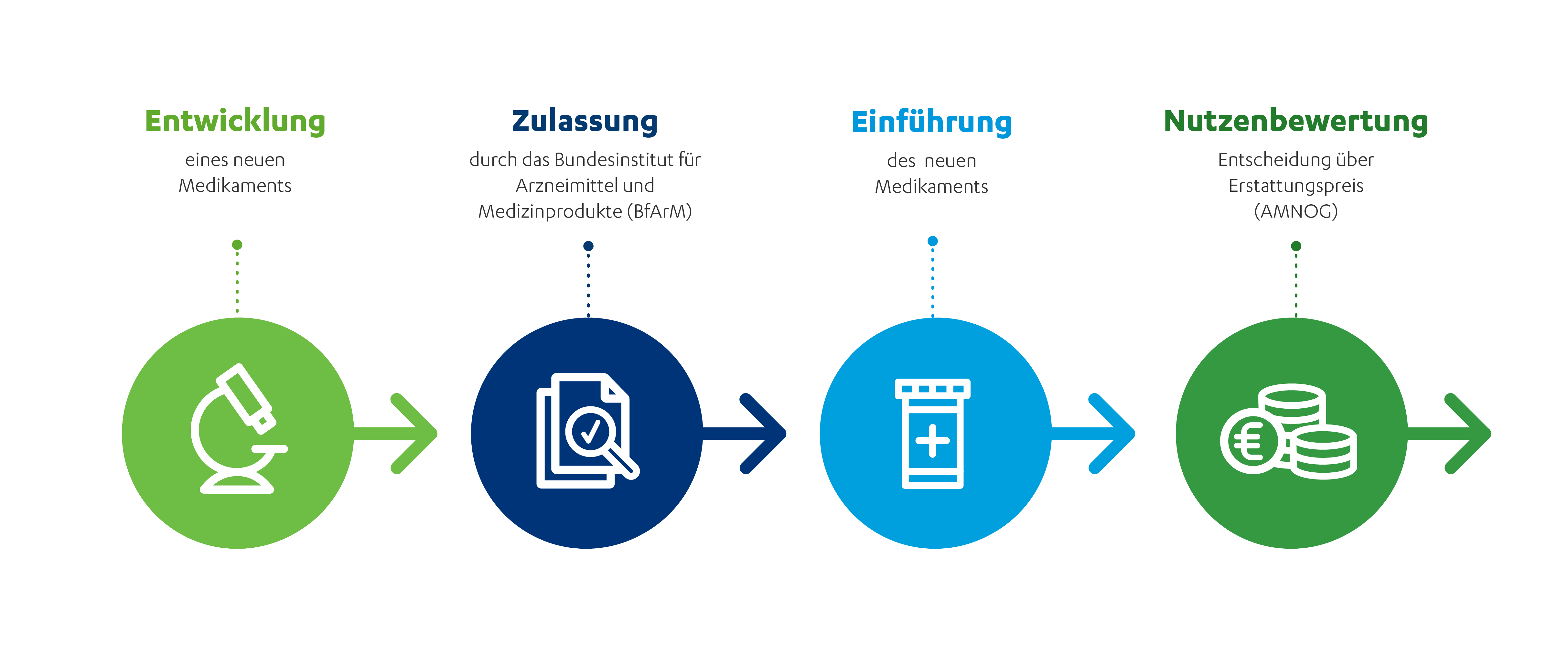
Seit Inkrafttreten des AMNOG hat die Medizin enorme Fortschritte gemacht. Wir können Krankheiten immer früher und präziser diagnostizieren, immer frühzeitiger, personalisierter und gezielter therapieren. Das AMNOG bildet diesen Fortschritt nicht ab. Je personalisierter ein Medikament ist, je früher und präziser es in den Krankheitsverlauf eingreift, desto schwerer ist, es in die Versorgung zu bringen. Zu beobachten ist diese Entwicklung insbesondere bei Medikamenten zur Behandlung von Erkrankungen, von denen nur wenige Menschen betroffen sind oder für die es noch keine Vergleichstherapie gibt. Das gilt selbst dann, wenn der medizinische Bedarf nachweislich hoch ist.
Um sicherzustellen, dass Patient:innen ohne vermeidbare Verzögerung einen frühzeitigen Zugang zu innovativen Therapien erhalten, ist es notwendig, die Methoden des AMNOG umsichtig an den Stand der wissenschaftlich-methodischen Erkenntnisse anzupassen. In diesem Kontext sollten beispielsweise neue Studiendesigns und klinische Endpunkte ergänzt und versorgungsnahe Daten bei der Bewertung neuer Therapien angemessen berücksichtigt werden.
AMNOG-Leitplanken erschweren den Zugang von Patient:innen zu Innovationen
Das 2022 verabschiedete GKV-Finanzstabilisierungsgesetz leistet die erforderliche Modernisierung des AMNOG nicht. Das vornehmliche Ziel der sogenannten AMNOG-Leitplanken ist nicht, das System in die Lage zu versetzen, medizinische Innovationen im Sinne von Patient:innen zu bewerten. Stattdessen sollen punktuell Einsparungen realisiert werden, indem das Prinzip „gleiche Preise für gleich gute Medikamente“ und „etwas höhere Preise für etwas bessere Medikamente“ ausgehebelt wird. Die Einführung innovativer Medikamente in den deutschen Markt – und damit der Zugang von Patient:innen zu diesen Innovationen – werden dadurch erheblich erschwert.
Moderne Medizin braucht Daten und digitale Vernetzung
Alle Patient:innen sollen die individuell bestmögliche Therapie erhalten – und zwar genau dann, wenn sie diese brauchen. Daten helfen uns dabei. Systematisch erhoben, verknüpft und ausgewertet, zeigen sie uns, wo es den größten Bedarf an neuen oder besseren Therapien gibt. Das ermöglicht uns, gezielt medizinische Innovationen zu entwickeln, die diesen Bedarf adressieren. Bereits zugelassene Therapien können wir auf Basis dieser Erkenntnisse so anpassen, dass sie noch besser auf die Anforderungen von Patient:innen zugeschnitten sind, weil sie zum Beispiel mit weniger Nebenwirkungen für die Betroffenen einhergehen.
Deshalb ist es wichtig, dass alle forschenden Akteur:innen im Gesundheitswesen, forschende Pharmaunternehmen eingeschlossen, Zugang zu den vorliegenden Gesundheitsdaten erhalten und diese zu Forschungszwecken nutzen können. Ebenso wichtig ist, Daten aus dem Versorgungsalltag umfassend bei der Nutzenbewertung zu berücksichtigen. Beides sind wichtige Schritte, die dazu beitragen, dass Patient:innen in Deutschland auch in Zukunft Zugang zu innovativen und verbesserten Medikamenten und Therapien haben. Mehr dazu erfahren Sie auf der Unterseite Daten und Digitalisierung.
Die Umsätze von heute ermöglichen die Innovationen von morgen
Pharmaforschung ist ein Hochrisikogeschäft: Von rund 10.000 möglichen Wirkstoffen schafft es durchschnittlich ein einziger bis zur Zulassung. Bis es so weit ist, vergehen in Deutschland bis zu 14 Jahre. Ein verlässlicher Patentschutz und eine faire, am Ergebnis orientierte Erstattung der heute zugelassenen Medikamente bieten Unternehmen die kalkulatorische Sicherheit, um das mit der Erforschung und Entwicklung einhergehende Investitionsrisiko zu schultern.
Patentschutz: Unverzichtbar für medizinische Innovationen
Ein verlässlicher Patentschutz (auch als „Schutz des geistigen Eigentums“ bezeichnet) ist für die Entwicklung innovativer Medikamente, Impfstoffe und digitaler sowie analoger Unterstützungsangebote für Patient:innen unverzichtbar. Das enorme Tempo der Impfstoffentwicklung während der Corona-Pandemie beispielsweise war nur möglich, weil die forschenden Unternehmen zuvor jahrzehntelang in die entsprechenden Technologien und Plattformen investiert haben. Der Schutz des geistigen Eigentums ermöglicht es forschenden Unternehmen darüber hinaus, Informationen über ihre Erfindungen frühzeitig und transparent zu teilen. Dadurch können andere Unternehmen die Erkenntnisse für alternative Ansätze und Weiterentwicklungen nutzen und zum Beispiel frühzeitig mit der Erforschung günstigerer Generika oder Biosimilars beginnen. Eine Wiederholung der kostenintensiven klinischen Studien ist dank der geteilten Daten dann nicht nötig, sodass Nachahmerpräparate ggf. bereits bei Patentablauf zur Verfügung gestellt werden können. Der Schutz des geistigen Eigentums sichert folglich den Kreislauf von Innovation und Produktverbesserung.
Politische Initiativen: Das EU-Pharmapaket
Die geplante Überarbeitung des Rechtsrahmens der Pharmaindustrie auf EU-Ebene (sogenanntes EU-Pharmapaket) könnte diesen Kreislauf aus der Balance bringen: Die EU-Kommission beabsichtigt, den Patentschutz zu verkürzen. Ein solcher Eingriff würde die Bereitschaft potenzieller Investor:innen, in Europa in Forschungs- und Entwicklungsprojekte zu investieren, schmälern. Das wiederum hätte unmittelbar negative Folgen für Europas Wettbewerbsfähigkeit, zum Beispiel im Vergleich mit den USA, und den Zugang von Patient:innen zu innovativen Arzneimitteln und Therapien. Mehr Informationen zum EU-Pharmapaket finden Sie auf der Website des vfa.
Weitere Informationen
Unser Ziel: Individuelle Behandlungen
Präzisionsmedizin
Moderne Medizin braucht Daten
Daten &
Digitalisierung
EM-137282
